Knowledge
Secara sederhana, definisi dari energi adalah kemampuan untuk menghasilkan usaha. Dalam ilmu fisika, usaha diartikan sebagai gaya yang dilakukan untuk memindahkan suatu benda sejauh jarak tertentu. Dengan kata lain, segala sesuatu yang berpindah menandakan kepemilikan akan energi. Namun, bukan berarti jika tidak ada perpindahan menandakan tidak adanya energi. Mengapa? Karena, sesuai dengan definisinya, poin penting selain perpindahan adalah kemampuan. Contoh, pada sebuah baterai tentunya tidak ditemukan adanya perpindahan bukan? Tapi, ketika baterai tersebut dipasang pada sebuah kipas angin kecil, maka akan timbul pergerakan pada baling-baling kipas. Artinya, baterai memiliki energi karena mampu menghasilkan perpindahan pada baling-baling kipas angin.
Contoh baterai dan kipas di atas juga menunjukan bahwa energi memiliki jenis yang bermacam-macam dan energi dapat berubah atau terkonversi dari satu jenis ke jenis lainnya. Selain itu, energi pun dapat berpindah. Energi yang tersimpan di dalam baterai adalah energi kimia. Saat terhubung dengan kipas angin melalui rangkaian elektronik, energi di dalam baterai tersebut dikonversi menjadi energi listrik yang kemudian berakhir menjadi energi kinetik yang ditandai dengan berputarnya baling-baling kipas. Energi berpindah dari baterai ke kipas angin.
Apakah pembaca pernah mendengar hukum kekekalan energi? Hukum yang dicetuskan oleh matematikawan dan filsuf Perancis, Émilie Du Châtelet, menyatakan bahwa energi tidak dapat diciptakan atau dimusnahkan. Hukum tersebut senada dengan Hukum Termodinamika ke-1, sebuah hukum yang sangat terkenal dalam dunia engineering. Secara garis besar, hukum tersebut menyatakan bahwa perubahan energi pada suatu sistem yang tertutup (closed system) terjadi jika ada interaksi dengan lingkungan dalam bentuk usaha (work) dan kalor (heat). Dengan kata lain, pengurangan energi tidak menandakan bahwa energi tersebut hilang, melainkan energi terkonversi atau berpindah ke lingkungan dalam bentuk usaha dan/atau kalor.
Penjelasan paragraf di atas mungkin bisa lebih dipahami jika pembaca mengingat-ingat kembali makna “Sistem” dan “Lingkungan” dalam ilmu fisika. Sistem merupakan objek yang diamati dalam studi, sedangkan lingkungan adalah segala sesuatu di luar sistem. Ambil contoh sebuah kompor gas yang memanaskan air di dalam panci yang tertutup. Pengamat bisa sesuka hati memilih mana sistem dan mana lingkungan sesuai dengan apa yang ingin diamati. Misal, jika yang ingin diamati adalah bagaimana perubahan sifat fisik tabung gas yang terhubung dengan kompor gas dan panci, maka tabung gas dianggap sebagai sistem, sedangkan kompor dan panci termasuk lingkungan. Sebaliknya, jika yang ingin diamati adalah panci, maka hal-hal lain di luar panci adalah lingkungan.
Dalam paragraf ke-4, istilah sistem yang tertutup (closed system) muncul dalam isi Hukum Termodinamika ke-1. Sistem yang tertutup merupakan sistem yang tidak memungkinkan adanya perubahan massa pada sistem tersebut. Misal pada contoh panci di atas, anggap lah di dalam panci terdapat air dengan massa sebesar 1 kg. Jika panci ditutup oleh penutup panci yang kemudian dikunci, maka massa air di dalam panci tidak akan bisa berubah. Sistem yang tertutup tidak memungkinkan adanya interaksi antara sistem (panci) dan lingkungan (objek disekitarnya) yang menyebabkan perubahan massa pada sistem. Berbeda halnya dengan sistem yang terbuka yang dalam Ilmu termodinamika dikenal dengan istilah control volumes. Sistem tersebut memungkinkan adanya perubahan massa pada sistem. Contohnya, pengamat melakukan studi pada sebuah selang yang salah satu ujungnya terhubung ke keran air dan ujung lainnya terbuka. Di contoh ini, selang berperan sebagai sistem. Saat keran air dibuka, maka air akan mengalir dari ujung keran hingga keluar dari ujung selang yang terbuka. Massa air yang mengalir pada sistem tentunya dapat berubah, sesuai dengan debit air yang dialirkan.
Setelah familiar dengan istilah-istilah yang kerap dijumpai di termodinamika yang telah dijelaskan di atas, mari kembali ke paragraf 4. Energi tidak bisa diciptakan dan tidak dapat dimusnahkan. Berkurangnya energi pada suatu sistem tidak menandakan bahwa energi hilang begitu saja sedangkan bertambahnya energi pada suatu sistem menandakan bahwa energi tidak tercipta begitu saja. Mari lihat kembali contoh kompor dan panci berisi air. Anggaplah panci didesain sedemikian rupa sehingga tutup panci masih dapat melakukan gerak translasi secara vertikal. Saat kompor belum dinyalakan, tidak terlihat perubahan apapun pada panci serta isinya. Namun, saat kompor dinyalakan, temperatur panci dan air beserta udara di dalam panci akan meningkat. Meningkatnya temperature udara pada panci menyebabkan terjadinya pemuaian, yang kemudian akibat dari pemuaian udara tersebut, tutup panci terdorong dan bergerak ke atas. Ilustrasinya dapat dilihat pada Gambar 1 di bawah ini.
Peningkatan temperatur pada air dan udara di dalam panci menunjukan adanya perubahan level energi pada keduanya. Jika kita menjadikan panci serta isinya sebagai sebuah sistem, sedangkan sumber api, tutup panci dan lainnya di luar panci sebagai lingkungan, maka kita bisa melihat bagaimana panci sebagai sebuah sistem yang tertutup dapat berinteraksi dengan lingkungan di sekitarnya dalam bentuk perpindahan energi.
Interaksi atau perpindahan energi yang sangat jelas dan utama adalah perpindahan energi dalam bentuk kalor. Perpindahan energi dalam bentuk kalor ini terjadi karena adanya perbedaan temperatur antara lingkungan dan sistem, yang mana arah aliran energi terjadi dari daerah bertemperatur tinggi ke temperatur rendah. Selain kalor, bentuk interaksi antara sistem dan lingkungan yang juga tak kalah penting adalah tergeraknya tutup panci akibat pemuaian dari udara. Pergerakan tersebut menandakan adanya perpindahan jarak, yang berdasarkan definisi di paragraf dua, artinya timbul perpindahan energi dalam bentuk usaha (work). Karena usaha timbul akibat pemuaian udara, yang mana udara termasuk ke dalam sistem, maka dapat diartikan bahwa sistem memberikan/melakukan usaha kepada lingkungan.
Ilustrasi dari perpindahan energi yang terjadi pada sistem ditunjukan pada Gambar 2. Garis putus-putus melambangkan batas antara sistem dan lingkungan. Area di dalam garis putus-putus yang melingkupi air dan udara merupakan sistem, sedangkan area di luar garis merupakan lingkungan. Dari sini, dapat terlihat bagaimana energi berpindah dari lingkungan ke sistem dalam bentuk kalor dan dari sistem ke lingkungan dalam bentuk usaha.
Jika menganggap sistem di atas sebagai sebuah mesin, dapat dengan mudah membayangkan kalor sebagai input dan usaha sebagai output. Untuk menghasilkan output berupa usaha, maka dibutuhkan input berupa kalor. Hal ini merupakan konsep paling sederhana dari cara kerja berbagai mesin di dunia nyata, terutama mesin pembangkit listrik. Pembangkit listrik memanfaatkan kalor yang dihasilkan dari, misalnya, pembakaran batu bara, untuk menghasilkan usaha berupa putaran turbin yang kemudian memutar generator dan menghasilkan listrik.
Kembali ke contoh sistem panci di atas, pembahasan sejauh ini hanya berkisar pada kalor dan usaha. Perlu pembaca cermati bahwa pembahasan mengenai kalor di paragraf-paragraf sebelumnya hampir selalu berkaitan dengan interaksi dan perpindahan energi. Baik kalor maupun usaha, keduanya merepresentasikan cara bagaimana energi berpindah baik dari sistem ke lingkungan maupun dari lingkungan ke sistem, namun keduanya bukan lah energi. Analoginya sama dengan OVO dan Gopay yang mana keduanya merupakan suatu cara dalam bertransaksi uang, namun keduanya tidak merepresentasikan uang itu sendiri.
Nah, ketika ada perpindahan energi dari dan/atau menuju sistem, perubahan level energi pada sistem perlu diamati. Dengan demikian, neraca energi pada sistem tersebut bisa diformulasikan sebagai berikut:
E1 adalah level energi dari sistem (air dan udara pada contoh di atas) saat belum terjadi perpindahan energi dan E2 adalah energi dari sistem saat setelah terjadi perpindahan energi. Oleh karena itu, formula di atas dapat dimaknai sebagai perubahan level energi (E2 – E1) yang disebabkan karena perpindahan energi melalui kalor (Q) dan usaha (W). Nilai Q yang positif menandakan energi masuk ke sistem dari lingkungan. Sebaliknya, nilai W yang positif menandakan energi keluar dari sistem ke lingkungan.
Apakah mungkin besar energi yang berpindah melalui kalor (Q) ke sistem bisa dikonversikan sepenuhnya menjadi usaha yang keluar dari sistem (W)? Hal ini berarti tidak ada perubahan pada level energi, E2 = E1, sehingga Q = W. Sebelum menjawab pertanyaan tersebut, mari pahami dulu energi yang ada pada sistem. Dalam ilmu termodinamika, segala jenis energi yang ada di bumi dapat dikategorikan menjadi 3 jenis, yaitu energi potensial, energi kinetik dan energi dalam.
Definisi secara umum dari energi potensial adalah energi yang tersimpan pada suatu sistem yang nilainya bergantung pada posisi relatif dari masing-masing bagian di dalam sistem. Salah satu contoh energi potensial yang paling umum dan mudah dipahami adalah energi potensial gravitasi. Sesuai dengan namanya, energi ini dipengaruhi oleh besar gaya gravitasi antara dua objek. Ambil contoh sistem yang terdiri dari sebuah bola dan daratan, seperti yang ditunjukan pada Gambar 3. Pada gambar tersebut, bola dengan massa M terlihat berada pada 3 posisi yang berbeda, yaitu menempel dengan daratan, berada 1 m dari daratan dan berada 2 m dari daratan. Nilai energi potensial gravitasi dihitung berdasarkan perkalian antara massa, gravitasi dan jarak antara bola dengan daratan, Artinya, saat bola menempel dengan daratan, nilai energi potensial yang dimiliki adalah 0. Saat bola berada pada ketinggian 2 m, nilai energi potensial akan lebih besar 2 kali lipat dari energi saat ketinggiannya 1 m. Selain energi potensial gravitasi, contoh lain dari energi potensial adalah energi potensial elastis, contohnya pada pegas yang tertekan atau tertarik, energi potensial elektrik pada medan listrik, serta energi potensial kimia (biasa juga disebut energi kimia) seperti energi yang tersimpan pada baterai dan energi yang tersimpan pada tubuh manusia.
Berbeda dengan energi potensial yang berhubungan dengan posisi tertentu, energi kinetik merupakan energi yang berhubungan dengan pergerakan dan kecepatan. Nilai energi kinetik berbanding lurus dengan massa dan berbanding lurus kuadratik dengan kecepatan. Semakin besar massa dan kecepatan dari suatu benda, maka energi kinetiknya pun akan semakin membesar. Energi potensial dan energi kinetik sangat umum dipasangkan satu sama lain untuk membentuk suatu energi yang dikenal dengan nama energi mekanik.
Konversi dari energi potensial dan energi kinetik cukup mudah dipahami. Ambil contoh seseorang bernama A mengangkat sebuah bola yang awalnya berada di daratan sampai ke ketinggian tertentu, kemudian bola dilepaskan untuk jatuh secara bebas ke daratan. Si A memiliki energi yang tersimpan dalam tubuhnya dalam bentuk energi kimia. Saat masih berada di daratan, bola tidak memiliki energi baik potensial maupun kinetik. Ketika A mengangkat bola tersebut sampai ketinggian tertentu, energi kimia si A berpindah ke bola melalui usaha yang dilakukan A yang kemudian energi tersimpan pada bola dalam bentuk energi potensial. Lalu, saat bola dilepaskan dan mulai bergerak jatuh, energi potensial pada bola terkonversi menjadi energi kinetik.
Jenis energi yang terakhir adalah energi dalam. Dalam ilmu termodinamika, energi dalam merupakan energi yang tidak termasuk dalam kategori energi kinetic dan energi potensial. Secara mikroskopis, energi dalam berhubungan dengan pergerakan dan konfigurasi dari molekul individual, atom dan partikel subatomik (Moran, et al., 2014). Perlu pembaca ketahui bahwa temperatur berpengaruh terhadap pergerakan dan kecepatan molekul, sehingga perubahan temperatur pada suatu sistem menyebabkan perubahan energi dalam dari sistem tersebut.
Dengan telah diperkenalkannya ketiga jenis energi; energi potensial, energi kinetik dan energi dalam, maka dapat dipahami bahwa energi pada suatu sistem bisa diformulasikan oleh penjumlahan ketiganya, seperti yang ditunjukan pada formula berikut:
Esistem adalah energi yang tersimpan pada sistem, PE adalah energi potensial, KE adalah energi kinetik dan U adalah energi dalam. Dengan demikian, formula yang ditunjukan pada paragraf 13 bisa diubah menjadi sebagai berikut:
Formula di atas dalam ilmu termodinamika dikenal dengan nama Energy Balance (keseimbangan energi) atau Conservation of Energy (kekekalan energi) pada sistem tertutup. Formula tersebut sangat penting dalam teknik mesin karena menjadi dasar formula dari berbagai prinsip kerja mesin-mesin yang ada.
Lalu, mari kembali ke pertanyaan di paragraf 14 mengenai kemungkinan kalor bisa sepenuhnya dikonversikan menjadi usaha. Melirik formula Energy Balance, konversi sepenuhnya kalor menjadi usaha menandakan nilai ?PE + ?KE + ?U sama besar dengan 0. Nyatanya, dalam contoh panci yang dipanaskan, temperatur sistem mengalami kenaikan saat energi berpindah dalam bentuk kalor ke sistem. Kenaikan temperatur berdampak pada kenaikan energi dalam. Dengan kata lain ?U ? 0, meskipun baik ?PE maupun ?KE nilainya 0, karena memang tidak ada perubahan pada energi potensial dan energi kinetik sistem setelah kalor mengalir. Dengan demikian, formula Energy Balance berubah menjadi:
?PE + ?KE + ?U = Q – W
?U = Q – W
Q = ?U + W
Q ? W
Perpindahan energi dalam bentuk kalor sama besar dengan nilai perubahan energi dalam sistem dan nilai usaha yang dilakukan oleh sistem ke lingkungan. Perlu dicatat bahwa ilustrasi ini adalah sebuah penyederhanaan yang teramat sangat. Namun, perubahan kalor menjadi usaha atau usaha menjadi kalor dalam sebuah sistem memang tidak memungkinkan untuk terjadi secara 100%. Hal ini didasarkan pada Hukum Termodinamika ke-2 versi Kelvin-Planck. Kutipan hukum tersebut yang diambil dari buku berjudul Fundamentals of Engineering Thermodynamics yang ditulis oleh Moran, dkk, dapat dilihat sebagai berikut:
“It is impossible for any system to operate in a thermodynamic cycle and deliver a net amount of energy by work to its surroundings while receiving energy by heat transfer from a single thermal reservoir.”
Energi Dalam Kaidah Ilmu Termodinamika
Energi, sebuah istilah yang amat sangat umum digunakan dalam kehidupan sehari-hari. Mulai dari olahraga, kesehatan, makanan dan minuman, sampai dengan industri dan pembangkit listrik, kita kerap kali menjumpai kata energi. Tapi, apakah pembaca tau, apa sih sebenarnya energi itu? Apa sih sebenarnya jenis-jenis energi? Mari kita bahas dari perspektif ilmu fisika, khususnya cabang ilmu termodinamika.Secara sederhana, definisi dari energi adalah kemampuan untuk menghasilkan usaha. Dalam ilmu fisika, usaha diartikan sebagai gaya yang dilakukan untuk memindahkan suatu benda sejauh jarak tertentu. Dengan kata lain, segala sesuatu yang berpindah menandakan kepemilikan akan energi. Namun, bukan berarti jika tidak ada perpindahan menandakan tidak adanya energi. Mengapa? Karena, sesuai dengan definisinya, poin penting selain perpindahan adalah kemampuan. Contoh, pada sebuah baterai tentunya tidak ditemukan adanya perpindahan bukan? Tapi, ketika baterai tersebut dipasang pada sebuah kipas angin kecil, maka akan timbul pergerakan pada baling-baling kipas. Artinya, baterai memiliki energi karena mampu menghasilkan perpindahan pada baling-baling kipas angin.
Contoh baterai dan kipas di atas juga menunjukan bahwa energi memiliki jenis yang bermacam-macam dan energi dapat berubah atau terkonversi dari satu jenis ke jenis lainnya. Selain itu, energi pun dapat berpindah. Energi yang tersimpan di dalam baterai adalah energi kimia. Saat terhubung dengan kipas angin melalui rangkaian elektronik, energi di dalam baterai tersebut dikonversi menjadi energi listrik yang kemudian berakhir menjadi energi kinetik yang ditandai dengan berputarnya baling-baling kipas. Energi berpindah dari baterai ke kipas angin.
Apakah pembaca pernah mendengar hukum kekekalan energi? Hukum yang dicetuskan oleh matematikawan dan filsuf Perancis, Émilie Du Châtelet, menyatakan bahwa energi tidak dapat diciptakan atau dimusnahkan. Hukum tersebut senada dengan Hukum Termodinamika ke-1, sebuah hukum yang sangat terkenal dalam dunia engineering. Secara garis besar, hukum tersebut menyatakan bahwa perubahan energi pada suatu sistem yang tertutup (closed system) terjadi jika ada interaksi dengan lingkungan dalam bentuk usaha (work) dan kalor (heat). Dengan kata lain, pengurangan energi tidak menandakan bahwa energi tersebut hilang, melainkan energi terkonversi atau berpindah ke lingkungan dalam bentuk usaha dan/atau kalor.
Penjelasan paragraf di atas mungkin bisa lebih dipahami jika pembaca mengingat-ingat kembali makna “Sistem” dan “Lingkungan” dalam ilmu fisika. Sistem merupakan objek yang diamati dalam studi, sedangkan lingkungan adalah segala sesuatu di luar sistem. Ambil contoh sebuah kompor gas yang memanaskan air di dalam panci yang tertutup. Pengamat bisa sesuka hati memilih mana sistem dan mana lingkungan sesuai dengan apa yang ingin diamati. Misal, jika yang ingin diamati adalah bagaimana perubahan sifat fisik tabung gas yang terhubung dengan kompor gas dan panci, maka tabung gas dianggap sebagai sistem, sedangkan kompor dan panci termasuk lingkungan. Sebaliknya, jika yang ingin diamati adalah panci, maka hal-hal lain di luar panci adalah lingkungan.
Dalam paragraf ke-4, istilah sistem yang tertutup (closed system) muncul dalam isi Hukum Termodinamika ke-1. Sistem yang tertutup merupakan sistem yang tidak memungkinkan adanya perubahan massa pada sistem tersebut. Misal pada contoh panci di atas, anggap lah di dalam panci terdapat air dengan massa sebesar 1 kg. Jika panci ditutup oleh penutup panci yang kemudian dikunci, maka massa air di dalam panci tidak akan bisa berubah. Sistem yang tertutup tidak memungkinkan adanya interaksi antara sistem (panci) dan lingkungan (objek disekitarnya) yang menyebabkan perubahan massa pada sistem. Berbeda halnya dengan sistem yang terbuka yang dalam Ilmu termodinamika dikenal dengan istilah control volumes. Sistem tersebut memungkinkan adanya perubahan massa pada sistem. Contohnya, pengamat melakukan studi pada sebuah selang yang salah satu ujungnya terhubung ke keran air dan ujung lainnya terbuka. Di contoh ini, selang berperan sebagai sistem. Saat keran air dibuka, maka air akan mengalir dari ujung keran hingga keluar dari ujung selang yang terbuka. Massa air yang mengalir pada sistem tentunya dapat berubah, sesuai dengan debit air yang dialirkan.
Setelah familiar dengan istilah-istilah yang kerap dijumpai di termodinamika yang telah dijelaskan di atas, mari kembali ke paragraf 4. Energi tidak bisa diciptakan dan tidak dapat dimusnahkan. Berkurangnya energi pada suatu sistem tidak menandakan bahwa energi hilang begitu saja sedangkan bertambahnya energi pada suatu sistem menandakan bahwa energi tidak tercipta begitu saja. Mari lihat kembali contoh kompor dan panci berisi air. Anggaplah panci didesain sedemikian rupa sehingga tutup panci masih dapat melakukan gerak translasi secara vertikal. Saat kompor belum dinyalakan, tidak terlihat perubahan apapun pada panci serta isinya. Namun, saat kompor dinyalakan, temperatur panci dan air beserta udara di dalam panci akan meningkat. Meningkatnya temperature udara pada panci menyebabkan terjadinya pemuaian, yang kemudian akibat dari pemuaian udara tersebut, tutup panci terdorong dan bergerak ke atas. Ilustrasinya dapat dilihat pada Gambar 1 di bawah ini.
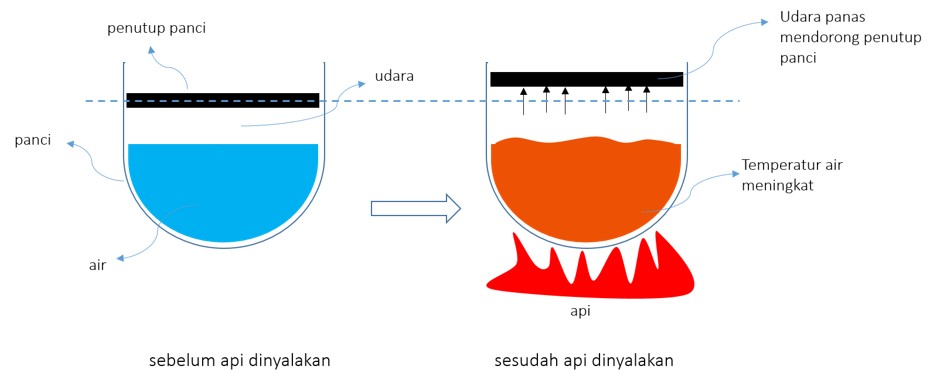
Gambar 1. Proses pemanasan air dan udara pada panci
Peningkatan temperatur pada air dan udara di dalam panci menunjukan adanya perubahan level energi pada keduanya. Jika kita menjadikan panci serta isinya sebagai sebuah sistem, sedangkan sumber api, tutup panci dan lainnya di luar panci sebagai lingkungan, maka kita bisa melihat bagaimana panci sebagai sebuah sistem yang tertutup dapat berinteraksi dengan lingkungan di sekitarnya dalam bentuk perpindahan energi.
Interaksi atau perpindahan energi yang sangat jelas dan utama adalah perpindahan energi dalam bentuk kalor. Perpindahan energi dalam bentuk kalor ini terjadi karena adanya perbedaan temperatur antara lingkungan dan sistem, yang mana arah aliran energi terjadi dari daerah bertemperatur tinggi ke temperatur rendah. Selain kalor, bentuk interaksi antara sistem dan lingkungan yang juga tak kalah penting adalah tergeraknya tutup panci akibat pemuaian dari udara. Pergerakan tersebut menandakan adanya perpindahan jarak, yang berdasarkan definisi di paragraf dua, artinya timbul perpindahan energi dalam bentuk usaha (work). Karena usaha timbul akibat pemuaian udara, yang mana udara termasuk ke dalam sistem, maka dapat diartikan bahwa sistem memberikan/melakukan usaha kepada lingkungan.
Ilustrasi dari perpindahan energi yang terjadi pada sistem ditunjukan pada Gambar 2. Garis putus-putus melambangkan batas antara sistem dan lingkungan. Area di dalam garis putus-putus yang melingkupi air dan udara merupakan sistem, sedangkan area di luar garis merupakan lingkungan. Dari sini, dapat terlihat bagaimana energi berpindah dari lingkungan ke sistem dalam bentuk kalor dan dari sistem ke lingkungan dalam bentuk usaha.
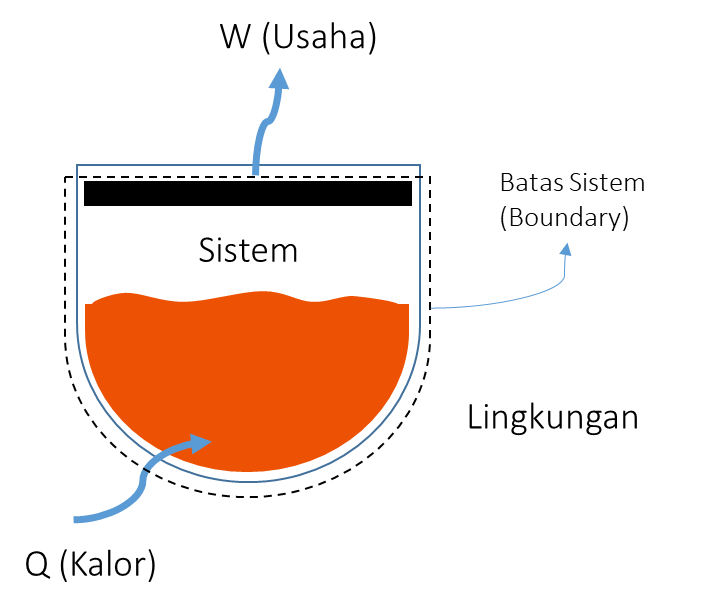
Jika menganggap sistem di atas sebagai sebuah mesin, dapat dengan mudah membayangkan kalor sebagai input dan usaha sebagai output. Untuk menghasilkan output berupa usaha, maka dibutuhkan input berupa kalor. Hal ini merupakan konsep paling sederhana dari cara kerja berbagai mesin di dunia nyata, terutama mesin pembangkit listrik. Pembangkit listrik memanfaatkan kalor yang dihasilkan dari, misalnya, pembakaran batu bara, untuk menghasilkan usaha berupa putaran turbin yang kemudian memutar generator dan menghasilkan listrik.
Kembali ke contoh sistem panci di atas, pembahasan sejauh ini hanya berkisar pada kalor dan usaha. Perlu pembaca cermati bahwa pembahasan mengenai kalor di paragraf-paragraf sebelumnya hampir selalu berkaitan dengan interaksi dan perpindahan energi. Baik kalor maupun usaha, keduanya merepresentasikan cara bagaimana energi berpindah baik dari sistem ke lingkungan maupun dari lingkungan ke sistem, namun keduanya bukan lah energi. Analoginya sama dengan OVO dan Gopay yang mana keduanya merupakan suatu cara dalam bertransaksi uang, namun keduanya tidak merepresentasikan uang itu sendiri.
Nah, ketika ada perpindahan energi dari dan/atau menuju sistem, perubahan level energi pada sistem perlu diamati. Dengan demikian, neraca energi pada sistem tersebut bisa diformulasikan sebagai berikut:
E2 – E1 = Q – W
E1 adalah level energi dari sistem (air dan udara pada contoh di atas) saat belum terjadi perpindahan energi dan E2 adalah energi dari sistem saat setelah terjadi perpindahan energi. Oleh karena itu, formula di atas dapat dimaknai sebagai perubahan level energi (E2 – E1) yang disebabkan karena perpindahan energi melalui kalor (Q) dan usaha (W). Nilai Q yang positif menandakan energi masuk ke sistem dari lingkungan. Sebaliknya, nilai W yang positif menandakan energi keluar dari sistem ke lingkungan.
Apakah mungkin besar energi yang berpindah melalui kalor (Q) ke sistem bisa dikonversikan sepenuhnya menjadi usaha yang keluar dari sistem (W)? Hal ini berarti tidak ada perubahan pada level energi, E2 = E1, sehingga Q = W. Sebelum menjawab pertanyaan tersebut, mari pahami dulu energi yang ada pada sistem. Dalam ilmu termodinamika, segala jenis energi yang ada di bumi dapat dikategorikan menjadi 3 jenis, yaitu energi potensial, energi kinetik dan energi dalam.
Definisi secara umum dari energi potensial adalah energi yang tersimpan pada suatu sistem yang nilainya bergantung pada posisi relatif dari masing-masing bagian di dalam sistem. Salah satu contoh energi potensial yang paling umum dan mudah dipahami adalah energi potensial gravitasi. Sesuai dengan namanya, energi ini dipengaruhi oleh besar gaya gravitasi antara dua objek. Ambil contoh sistem yang terdiri dari sebuah bola dan daratan, seperti yang ditunjukan pada Gambar 3. Pada gambar tersebut, bola dengan massa M terlihat berada pada 3 posisi yang berbeda, yaitu menempel dengan daratan, berada 1 m dari daratan dan berada 2 m dari daratan. Nilai energi potensial gravitasi dihitung berdasarkan perkalian antara massa, gravitasi dan jarak antara bola dengan daratan, Artinya, saat bola menempel dengan daratan, nilai energi potensial yang dimiliki adalah 0. Saat bola berada pada ketinggian 2 m, nilai energi potensial akan lebih besar 2 kali lipat dari energi saat ketinggiannya 1 m. Selain energi potensial gravitasi, contoh lain dari energi potensial adalah energi potensial elastis, contohnya pada pegas yang tertekan atau tertarik, energi potensial elektrik pada medan listrik, serta energi potensial kimia (biasa juga disebut energi kimia) seperti energi yang tersimpan pada baterai dan energi yang tersimpan pada tubuh manusia.
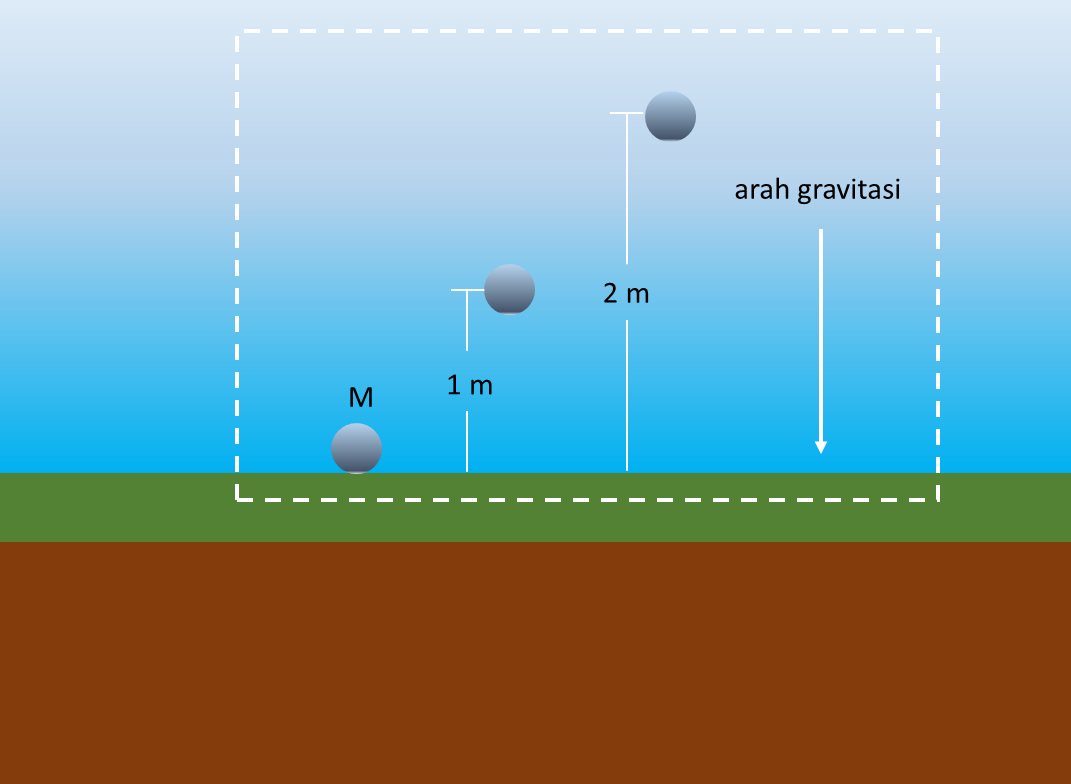
Berbeda dengan energi potensial yang berhubungan dengan posisi tertentu, energi kinetik merupakan energi yang berhubungan dengan pergerakan dan kecepatan. Nilai energi kinetik berbanding lurus dengan massa dan berbanding lurus kuadratik dengan kecepatan. Semakin besar massa dan kecepatan dari suatu benda, maka energi kinetiknya pun akan semakin membesar. Energi potensial dan energi kinetik sangat umum dipasangkan satu sama lain untuk membentuk suatu energi yang dikenal dengan nama energi mekanik.
Konversi dari energi potensial dan energi kinetik cukup mudah dipahami. Ambil contoh seseorang bernama A mengangkat sebuah bola yang awalnya berada di daratan sampai ke ketinggian tertentu, kemudian bola dilepaskan untuk jatuh secara bebas ke daratan. Si A memiliki energi yang tersimpan dalam tubuhnya dalam bentuk energi kimia. Saat masih berada di daratan, bola tidak memiliki energi baik potensial maupun kinetik. Ketika A mengangkat bola tersebut sampai ketinggian tertentu, energi kimia si A berpindah ke bola melalui usaha yang dilakukan A yang kemudian energi tersimpan pada bola dalam bentuk energi potensial. Lalu, saat bola dilepaskan dan mulai bergerak jatuh, energi potensial pada bola terkonversi menjadi energi kinetik.
Jenis energi yang terakhir adalah energi dalam. Dalam ilmu termodinamika, energi dalam merupakan energi yang tidak termasuk dalam kategori energi kinetic dan energi potensial. Secara mikroskopis, energi dalam berhubungan dengan pergerakan dan konfigurasi dari molekul individual, atom dan partikel subatomik (Moran, et al., 2014). Perlu pembaca ketahui bahwa temperatur berpengaruh terhadap pergerakan dan kecepatan molekul, sehingga perubahan temperatur pada suatu sistem menyebabkan perubahan energi dalam dari sistem tersebut.
Dengan telah diperkenalkannya ketiga jenis energi; energi potensial, energi kinetik dan energi dalam, maka dapat dipahami bahwa energi pada suatu sistem bisa diformulasikan oleh penjumlahan ketiganya, seperti yang ditunjukan pada formula berikut:
Esistem = PE + KE + U
Esistem adalah energi yang tersimpan pada sistem, PE adalah energi potensial, KE adalah energi kinetik dan U adalah energi dalam. Dengan demikian, formula yang ditunjukan pada paragraf 13 bisa diubah menjadi sebagai berikut:
E2 – E1 = Q – W
(PE2 + KE2 + U2) - (PE1 + KE1 + U1) = Q – W
?PE + ?KE + ?U = Q - W
(PE2 + KE2 + U2) - (PE1 + KE1 + U1) = Q – W
?PE + ?KE + ?U = Q - W
Formula di atas dalam ilmu termodinamika dikenal dengan nama Energy Balance (keseimbangan energi) atau Conservation of Energy (kekekalan energi) pada sistem tertutup. Formula tersebut sangat penting dalam teknik mesin karena menjadi dasar formula dari berbagai prinsip kerja mesin-mesin yang ada.
Lalu, mari kembali ke pertanyaan di paragraf 14 mengenai kemungkinan kalor bisa sepenuhnya dikonversikan menjadi usaha. Melirik formula Energy Balance, konversi sepenuhnya kalor menjadi usaha menandakan nilai ?PE + ?KE + ?U sama besar dengan 0. Nyatanya, dalam contoh panci yang dipanaskan, temperatur sistem mengalami kenaikan saat energi berpindah dalam bentuk kalor ke sistem. Kenaikan temperatur berdampak pada kenaikan energi dalam. Dengan kata lain ?U ? 0, meskipun baik ?PE maupun ?KE nilainya 0, karena memang tidak ada perubahan pada energi potensial dan energi kinetik sistem setelah kalor mengalir. Dengan demikian, formula Energy Balance berubah menjadi:
?U = Q – W
Q = ?U + W
Q ? W
Perpindahan energi dalam bentuk kalor sama besar dengan nilai perubahan energi dalam sistem dan nilai usaha yang dilakukan oleh sistem ke lingkungan. Perlu dicatat bahwa ilustrasi ini adalah sebuah penyederhanaan yang teramat sangat. Namun, perubahan kalor menjadi usaha atau usaha menjadi kalor dalam sebuah sistem memang tidak memungkinkan untuk terjadi secara 100%. Hal ini didasarkan pada Hukum Termodinamika ke-2 versi Kelvin-Planck. Kutipan hukum tersebut yang diambil dari buku berjudul Fundamentals of Engineering Thermodynamics yang ditulis oleh Moran, dkk, dapat dilihat sebagai berikut:
“It is impossible for any system to operate in a thermodynamic cycle and deliver a net amount of energy by work to its surroundings while receiving energy by heat transfer from a single thermal reservoir.”
Author





 31764
31764



 15 Mar 2022
15 Mar 2022 8102 kali
8102 kali





